ПЦР (полимеразная цепная реакция) — одна из технологий амплификации ДНК in vitro, история которой насчитывает более 30 лет.
Технология ПЦР была впервые предложена Кэри Маллисом из Цетуса, США, в 1983 году. Маллис подала заявку на патент ПЦР в 1985 году и в том же году опубликовала первую научную статью о ПЦР.Муллис был удостоен Нобелевской премии по химии в 1993 году за свою работу.
Основные принципы ПЦР
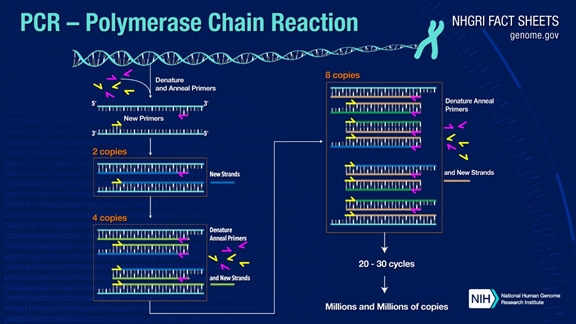
ПЦР может амплифицировать целевые фрагменты ДНК более чем в миллион раз.Принцип заключается в катализе ДНК-полимеразы с использованием исходной цепи ДНК в качестве матрицы и специфического праймера в качестве отправной точки для удлинения.Он реплицируется in vitro с помощью таких этапов, как денатурация, отжиг и удлинение.Процесс комплементарности дочерней цепи ДНК матричной ДНК родительской цепи.
Стандартный процесс ПЦР делится на три этапа:
1. Денатурация: используйте высокую температуру для разделения двойных цепей ДНК.Водородная связь между двойными нитями ДНК разрывается при высокой температуре (93-98℃).
2. Отжиг: после разделения двухцепочечной ДНК понизьте температуру, чтобы праймер мог связаться с одноцепочечной ДНК.
3. Расширение: ДНК-полимераза начинает синтезировать комплементарные цепи вдоль цепей ДНК из связанных праймеров при понижении температуры.Когда удлинение завершено, цикл завершается, и количество фрагментов ДНК удваивается.
Повторяя эти три шага 25-35 раз, количество фрагментов ДНК будет увеличиваться в геометрической прогрессии.
Изобретательность ПЦР заключается в том, что для разных генов-мишеней можно создавать разные праймеры, так что фрагменты генов-мишеней могут быть амплифицированы за короткий период времени.
Пока что ПЦР можно разделить на три категории, а именно обычную ПЦР, флуоресцентную количественную ПЦР и цифровую ПЦР.
Первое поколение обычной ПЦР
Используйте обычный инструмент для амплификации ПЦР для амплификации гена-мишени, а затем используйте электрофорез в агарозном геле для обнаружения продукта, можно провести только качественный анализ.
Основные недостатки ПЦР первого поколения:
1.Склонен к неспецифической амплификации и ложноположительным результатам.
2. Обнаружение занимает много времени, а операция громоздка.
3. Можно провести только качественный тест
ПЦР в реальном времени второго поколения
ПЦР в реальном времени, также известная как кПЦР, использует флуоресцентные зонды, которые могут указывать на ход реакционной системы, и отслеживает накопление амплифицированных продуктов посредством накопления флуоресцентных сигналов и оценивает результаты по кривой флуоресценции.Его можно количественно определить с помощью значения Cq и стандартной кривой.
Поскольку технология кПЦР осуществляется в закрытой системе, снижается вероятность контаминации, а сигнал флуоресценции можно контролировать для количественного определения, поэтому она наиболее широко используется в клинической практике и стала доминирующей технологией в ПЦР.
Флуоресцентные вещества, используемые в количественной флуоресцентной ПЦР в реальном времени, можно разделить на: флуоресцентный зонд TaqMan, молекулярные маяки и флуоресцентный краситель.
1) флуоресцентный зонд TaqMan:
Во время ПЦР-амплификации добавляется специфический флуоресцентный зонд при добавлении пары праймеров.Зонд представляет собой олигонуклеотид, и оба его конца помечены репортерной флуоресцентной группой и флуоресцентной группой гасителя.
Когда зонд не поврежден, флуоресцентный сигнал, испускаемый репортерной группой, поглощается гасящей группой;во время ПЦР-амплификации 5'-3'-экзонуклеазная активность фермента Taq расщепляет и разрушает зонд, в результате чего репортерная флуоресцентная группа и гаситель флуоресцентной группы разделяются, так что система мониторинга флуоресценции может получать флуоресцентный сигнал, то есть каждый раз, когда амплифицируется нить ДНК, образуется флуоресцентная молекула, а накопление флуоресцентного сигнала полностью синхронизируется с образованием продукта ПЦР.
2) флуоресцентный краситель SYBR:
В реакционную систему ПЦР добавляют избыток флуоресцентного красителя SYBR.После того, как флуоресцентный краситель SYBR неспецифически встраивается в двойную цепь ДНК, он излучает флуоресцентный сигнал.Молекула красителя SYBR, не включенная в цепь, не будет излучать никакого флуоресцентного сигнала, тем самым обеспечивая флуоресцентный сигнал. Увеличение продуктов ПЦР полностью синхронизировано с увеличением продуктов ПЦР.SYBR связывается только с двухцепочечной ДНК, поэтому кривую плавления можно использовать для определения специфичности реакции ПЦР.
3) Молекулярный маяк:
Это олигонуклеотидный зонд с двойной меткой «стебель-петля», который образует структуру шпильки примерно из 8 оснований на 5-м и 3-м концах.Последовательности нуклеиновых кислот на обоих концах комплементарно спарены, в результате чего флуоресцентная группа и группа гашения являются плотными.Закрыть, флуоресценции не будет.
После получения продукта ПЦР в процессе отжига средняя часть молекулярного маяка соединяется с определенной последовательностью ДНК, а флуоресцентный ген отделяется от гена гасителя для получения флуоресценции.
Основные недостатки ПЦР второго поколения:
Чувствительность по-прежнему недостаточна, а обнаружение малокопийных экземпляров неточно.
Существует влияние фонового значения, и результат чувствителен к помехам.
Когда в реакционной системе присутствуют ингибиторы ПЦР, результаты детекции подвержены помехам.
Цифровая ПЦР третьего поколения
Цифровая ПЦР (DigitalPCR, dPCR, Dig-PCR) рассчитывает количество копий целевой последовательности посредством определения конечной точки и может выполнять точное абсолютное количественное определение без использования внутренних контролей и стандартных кривых.
Цифровая ПЦР использует обнаружение конечной точки и не зависит от значения Ct (порог цикла), поэтому эффективность амплификации в меньшей степени влияет на реакцию цифровой ПЦР, а устойчивость к ингибиторам реакции ПЦР улучшается с высокой точностью и воспроизводимостью.
Благодаря характеристикам высокой чувствительности и высокой точности, ингибиторы реакции ПЦР не мешают ему, и он может обеспечить истинную абсолютную количественную оценку без стандартных продуктов, что стало горячей точкой исследований и приложений.
В соответствии с различными формами реакционного блока его можно разделить на три основных типа: микрожидкостные, чиповые и капельные системы.
1) Микрофлюидная цифровая ПЦР, мдПЦР:
На основе микрофлюидной технологии выделяется матрица ДНК.Микрофлюидная технология может реализовать нанообновление образца или создание капель меньшего размера, но для капель требуется специальный метод адсорбции, а затем их объединение с реакционной системой ПЦР.mdPCR постепенно заменяется другими методами.
2) Цифровая ПЦР на основе капель, ddPCR:
Используйте технологию генерирования капель воды в масле для обработки образца в капли и разделите реакционную систему, содержащую молекулы нуклеиновой кислоты, на тысячи наноразмерных капель, каждая из которых не содержит молекулу-мишень нуклеиновой кислоты, подлежащую обнаружению, или содержит от одной до нескольких молекул-мишеней нуклеиновой кислоты, подлежащих тестированию.
3) Цифровая ПЦР на основе чипа, cdPCR:
Используйте технологию интегрированного потока жидкости, чтобы выгравировать множество микротрубок и микрополостей на кремниевых пластинах или кварцевом стекле, и контролировать поток раствора через различные регулирующие клапаны, а также разделять жидкость образца на нанометры одинакового размера в реакционные лунки для цифровой ПЦР-реакции для достижения абсолютного количественного определения.
Основные недостатки ПЦР третьего поколения:
Оборудование и реагенты дорогие.
Требования к качеству шаблона высокие.Если количество шаблонов превышает количество микросистемы, будет невозможно количественно определить, а если оно слишком мало, то точность количественного определения будет снижена.
Ложноположительные результаты также могут быть получены при неспецифической амплификации.
Время публикации: 30 июля 2021 г.