Антитела, также называемые иммуноглобулинами (Ig), представляют собой гликопротеины, которые специфически связываются с антигенами.
Традиционный препарат антител получают путем иммунизации животных и сбора антисыворотки.Поэтому антисыворотка обычно содержит антитела против других неродственных антигенов и других белковых компонентов сыворотки.Молекулы общего антигена в основном содержат несколько разных эпитопов, поэтому обычные антитела также представляют собой смесь антител против нескольких разных эпитопов.Даже обычные сывороточные антитела, направленные против одного и того же эпитопа, по-прежнему состоят из гетерогенных антител, продуцируемых разными клонами В-клеток.Поэтому обычные сывороточные антитела также называют поликлональными антителами или для краткости поликлональными антителами.
Моноклональное антитело (моноклональное антитело) представляет собой высокооднородное антитело, продуцируемое одним клоном В-клетки и направленное только против определенного эпитопа.Обычно его получают с помощью гибридомной технологии - технология гибридомных антител основана на технологии слияния клеток, объединяющей В-клетки со способностью секретировать специфические антитела и клетки миеломы с бесконечной способностью роста в гибридомы В-клеток.Эта гибридомная клетка имеет характеристики родительской клетки.Он может неограниченно и бессмертно размножаться in vitro, подобно клеткам миеломы, и может синтезировать и секретировать специфические антитела, подобно лимфоцитам селезенки.Путем клонирования может быть получена моноклональная линия, полученная из одной клетки гибридомы, то есть линия клеток гибридомы.Антитела, которые он продуцирует, являются высоко гомогенными антителами против одной и той же антигенной детерминанты, то есть моноклональными антителами.
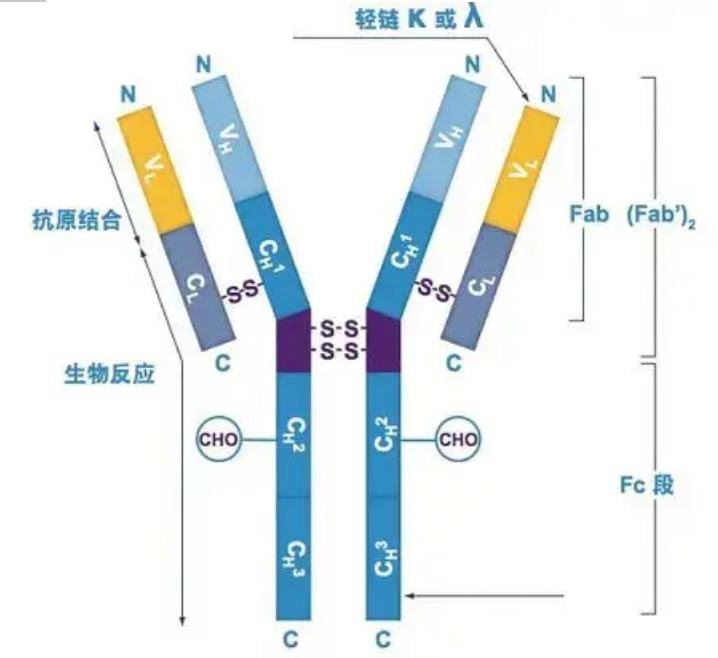
Антитела существуют в виде одного или нескольких Y-образных мономеров (т.е. моноклональные антитела или поликлональные антитела).Каждый Y-образный мономер состоит из 4 полипептидных цепей, включая две идентичные тяжелые цепи и две идентичные легкие цепи.Легкая цепь и тяжелая цепь названы в соответствии с их молекулярной массой.Вершина Y-образной структуры представляет собой вариабельную область, которая представляет собой сайт связывания антигена.(Выдержка из концепции биомоноклональных антител Detai)
Структура антител
 Тяжелая цепь
Тяжелая цепь
Существует пять типов тяжелых цепей Ig млекопитающих, названных греческими буквами α, δ, ε, γ и μ.Соответствующие антитела называются IgA, IgD, IgE, IgG и IgM.Различные тяжелые цепи различаются по размеру и составу.α и γ содержат примерно 450 аминокислот, а μ и ε содержат примерно 550 аминокислот.
Каждая тяжелая цепь имеет две области: константную область и вариабельную область.Все антитела одного типа имеют одинаковую константную область, но между антителами разных типов есть различия.Константные области тяжелых цепей γ, α и δ состоят из трех доменов Ig, расположенных тандемно, с шарнирной областью для повышения ее гибкости;константные области тяжелых цепей μ и ε состоят из 4 доменов Ig.Вариабельная область тяжелой цепи антитела, продуцируемого разными В-клетками, отличается, но вариабельная область антитела, продуцируемого одной и той же В-клеткой или клеточным клоном, одинакова, и вариабельная область каждой тяжелой цепи имеет длину около 110 аминокислот., И образуют единый домен Ig.
Легкая цепь
У млекопитающих есть только два типа легких цепей: лямбда-тип и каппа-тип.Каждая легкая цепь имеет два связанных домена: константную область и вариабельную область.Длина легкой цепи составляет примерно 211–217 аминокислот.Две легкие цепи, содержащиеся в каждом антителе, всегда одинаковы.У млекопитающих легкая цепь в каждом антителе имеет только один тип: каппа или лямбда.У некоторых низших позвоночных, таких как хрящевые рыбы (хрящевые рыбы) и костные рыбы, также обнаруживаются другие типы легких цепей, такие как тип йота (iota).
Fab- и Fc-сегменты
Fc-сегмент можно напрямую комбинировать с ферментами или флуоресцентными красителями для мечения антител.Это часть, где антитело прикрепляется к планшету во время процесса ELISA, а также часть, где второе антитело распознается и связывается при иммунопреципитации, иммуноблотинге и иммуногистохимии.Антитела могут быть гидролизованы на два F(ab)-сегмента и один Fc-сегмент с помощью протеолитических ферментов, таких как папаин, или они могут быть отделены от шарнирной области пепсином и гидролизованы на один F(ab)2-сегмент и один Fc-сегмент.Фрагменты антител IgG иногда очень полезны.Из-за отсутствия Fc-сегмента F(ab)-сегмент не осаждается антигеном и не захватывается иммунными клетками в исследованиях in vivo.Из-за небольших молекулярных фрагментов и отсутствия сшивающей функции (из-за отсутствия Fc-сегмента) Fab-сегмент обычно используется для мечения радиоактивным изотопом в функциональных исследованиях, а Fc-сегмент в основном используется в качестве блокирующего агента при гистохимическом окрашивании.
Переменные и постоянные области
Вариабельная область (V-область) расположена на 1/5 или 1/4 (содержащая примерно 118 аминокислотных остатков) Н-цепи вблизи N-конца и на 1/2 (содержащая примерно 108-111 аминокислотных остатков) вблизи N-конца L-цепи.Каждая V-область имеет пептидное кольцо, образованное внутрицепочечными дисульфидными связями, и каждое пептидное кольцо содержит приблизительно от 67 до 75 аминокислотных остатков.Состав и расположение аминокислот в V-области определяют антигенсвязывающую специфичность антитела.Из-за постоянно меняющихся типов и последовательности аминокислот в V-области могут образовываться многие виды антител с различной специфичностью связывания антигена.Участки V L-цепи и H-цепи называются соответственно VL и VH.В ВЛ и ВГ аминокислотный состав и последовательность некоторых локальных участков имеют более высокую степень изменчивости.Эти области называются гипервариабельными областями (HVR).Аминокислотный состав и расположение не-HVR частей в V-области относительно консервативны, что называется каркасной областью.В VL есть три гипервариабельных участка, обычно расположенных на аминокислотных остатках с 24 по 34 и с 89 по 97 соответственно.Три HVR VL и VH называются HVR1, HVR2 и HVR3 соответственно.Исследование и анализ дифракции рентгеновских лучей доказали, что гипервариабельная область действительно является местом, где связывается антиген антитела, поэтому ее называют областью, определяющей комплементарность (CDR).HVR1, HVR2 и HVR3 VL и VH могут называться CDR1, CDR2 и CDR3 соответственно.Как правило, CDR3 имеет более высокую степень гипервариабельности.Гипервариабельная область также является основным местом, где существуют идиотипические детерминанты молекул Ig.В большинстве случаев Н-цепь играет более важную роль в связывании с антигеном.
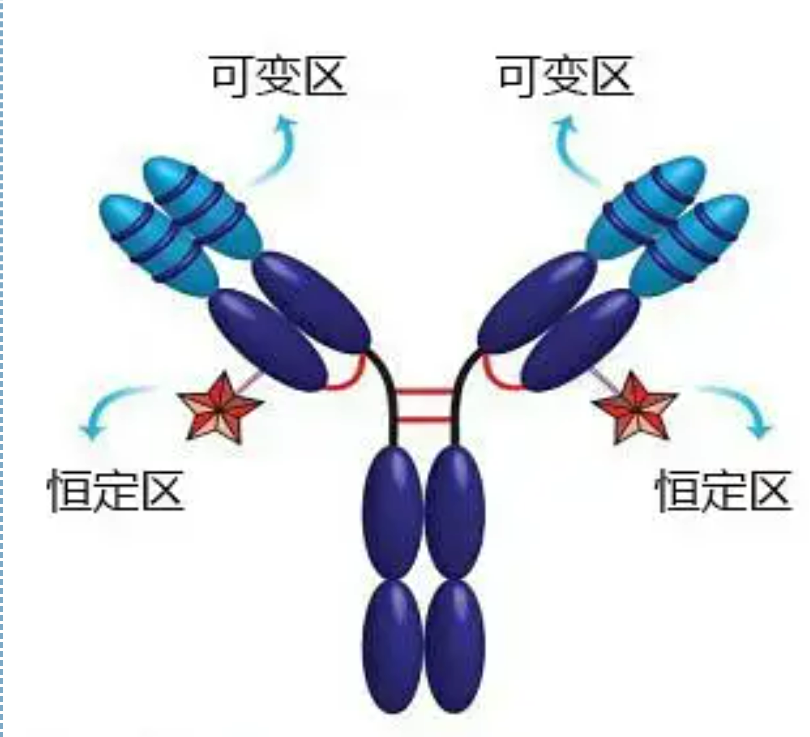 Постоянная область (область C)располагается на 3/4 или 4/5 (примерно от аминокислоты 119 до С-конца) Н-цепи вблизи С-конца и на 1/2 (содержит около 105 аминокислотных остатков) вблизи С-конца L-цепи.Каждая функциональная область Н-цепи содержит около 110 аминокислотных остатков и содержит пептидное кольцо, состоящее из 50-60 аминокислотных остатков, соединенных дисульфидными связями.Аминокислотный состав и расположение этой области относительно постоянны в одной и той же L-цепи изотипа Ig животных и в одной и той же H-цепи.То же самое, он может только специфически связываться с соответствующим антигеном, но строение его С-области такое же, т. е. он обладает такой же антигенностью.Лошадиное вторичное антитело против человеческого IgG (или анти-антитело) может быть объединено с двумя комбинациями антител (IgG) против различных экзотоксинов.Это важная основа для получения вторичных антител и применения флуоресцеина, изотопов, ферментов и других меченых антител.
Постоянная область (область C)располагается на 3/4 или 4/5 (примерно от аминокислоты 119 до С-конца) Н-цепи вблизи С-конца и на 1/2 (содержит около 105 аминокислотных остатков) вблизи С-конца L-цепи.Каждая функциональная область Н-цепи содержит около 110 аминокислотных остатков и содержит пептидное кольцо, состоящее из 50-60 аминокислотных остатков, соединенных дисульфидными связями.Аминокислотный состав и расположение этой области относительно постоянны в одной и той же L-цепи изотипа Ig животных и в одной и той же H-цепи.То же самое, он может только специфически связываться с соответствующим антигеном, но строение его С-области такое же, т. е. он обладает такой же антигенностью.Лошадиное вторичное антитело против человеческого IgG (или анти-антитело) может быть объединено с двумя комбинациями антител (IgG) против различных экзотоксинов.Это важная основа для получения вторичных антител и применения флуоресцеина, изотопов, ферментов и других меченых антител.
Сопутствующие товары:
Набор Cell Direct RT-qPCR
Время публикации: 30 сентября 2021 г.








